2021.10.22
「神経幹細胞の運命転換の分子メカニズム解明に成功」(基盤幹細胞学分野 中島欽一教授)
神経幹細胞の運命転換の分子メカニズム解明に成功
〜同じ分化誘導因子に応じて、異なる細胞を作り分ける仕組み〜
概 要
脳が発生する際には、神経幹細胞(※1)が異なる細胞を適切なタイミングで、決まった数作る必要があります。発生期の神経幹細胞は、まず神経細胞(ニューロン)を産み出し、その後にニューロンの機能を助ける細胞(アストロサイト)を産生することが分かっていましたが、この分化能変換のメカニズムはよく分かっていませんでした。
九州大学大学院医学研究院の堅田明子助教・中島欽一教授らの研究グループは、発生期の神経幹細胞が脳を形成する過程で、自身の遺伝的性質(エピゲノム※2)を変化させることで、同じ分化誘導因子に対しても、発生時期に応じて、ニューロンとアストロサイトを適切に作り分けること、またその分子メカニズムの詳細を解明することに成功しました。
今回、研究グループはマウス胎生11日由来と胎生14日由来神経幹細胞では、分化誘導因子である骨形成因子(※3)に対して、ニューロンとアストロサイトと異なる細胞を産み出すことに着目し、この二つの発生時期において骨形成因子の下流シグナルが標的とする遺伝子を全ゲノムレベルで解析しました。その結果、神経幹細胞が発生時期に応じて、クロマチン構造(※4)を適切に変化させること、またそれぞれの発生時期で異なる転写因子(※5)とパートナーになることで、精妙に産生する細胞種を制御することを明らかにしました。近年、脳発生の異常、ニューロンとアストロサイトの数のバランス異常が種々の発達障害・精神疾患に結びつくことが分かってきています。神経幹細胞が分化能を変換させる際の詳細な分子機構を明らかにすることは、これら疾患の発症メカニズムを理解するために重要となります。
本研究成果は、2021年10月21日(木)午後3時(米国東部標準時間)に国際学術雑誌『Genes & Development』にオンラインで掲載されました。なお、本研究は日本学術振興会科研費(JP16H06527, JP16K21734, JP26710003, JP20K06875)、国立研究開発法人科学技術振興機構 CREST(JPMJCR16G1)、内藤記念科学研究助成金の支援を受けました。
脳が発生する際には、神経幹細胞(※1)が異なる細胞を適切なタイミングで、決まった数作る必要があります。発生期の神経幹細胞は、まず神経細胞(ニューロン)を産み出し、その後にニューロンの機能を助ける細胞(アストロサイト)を産生することが分かっていましたが、この分化能変換のメカニズムはよく分かっていませんでした。
九州大学大学院医学研究院の堅田明子助教・中島欽一教授らの研究グループは、発生期の神経幹細胞が脳を形成する過程で、自身の遺伝的性質(エピゲノム※2)を変化させることで、同じ分化誘導因子に対しても、発生時期に応じて、ニューロンとアストロサイトを適切に作り分けること、またその分子メカニズムの詳細を解明することに成功しました。
今回、研究グループはマウス胎生11日由来と胎生14日由来神経幹細胞では、分化誘導因子である骨形成因子(※3)に対して、ニューロンとアストロサイトと異なる細胞を産み出すことに着目し、この二つの発生時期において骨形成因子の下流シグナルが標的とする遺伝子を全ゲノムレベルで解析しました。その結果、神経幹細胞が発生時期に応じて、クロマチン構造(※4)を適切に変化させること、またそれぞれの発生時期で異なる転写因子(※5)とパートナーになることで、精妙に産生する細胞種を制御することを明らかにしました。近年、脳発生の異常、ニューロンとアストロサイトの数のバランス異常が種々の発達障害・精神疾患に結びつくことが分かってきています。神経幹細胞が分化能を変換させる際の詳細な分子機構を明らかにすることは、これら疾患の発症メカニズムを理解するために重要となります。
本研究成果は、2021年10月21日(木)午後3時(米国東部標準時間)に国際学術雑誌『Genes & Development』にオンラインで掲載されました。なお、本研究は日本学術振興会科研費(JP16H06527, JP16K21734, JP26710003, JP20K06875)、国立研究開発法人科学技術振興機構 CREST(JPMJCR16G1)、内藤記念科学研究助成金の支援を受けました。
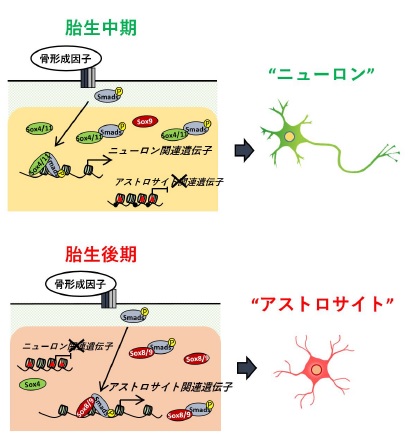 |
【参考図】胎生中期と後期の神経幹細胞では、エピゲノムや発現している転写因子が異なるため、たとえ同じ骨形成因子で分化誘導刺激を行った際でも、胎生中期にはニューロン関連遺伝子が、胎生後期ではアストロサイト関連遺伝子の発現が誘導され、発生時期に応じて、異なる細胞を産み出すことが明らかとなった。 |
|
研究者からひとこと:神経幹細胞は自身のエピゲノムを含めた細胞の性質を発生過程で、精妙に変化させることで、適切な時期に必要な細胞を産み出すことが分かりましたが、これらの変化がどのようにして神経幹細胞で生じているのかはまだ不明です。神経幹細胞の分化能変換の詳細な分子機構解明は、発達障害や精神疾患の発症メカニズムの理解にも重要であるため、これらに役立てていきたいと考えています。
|
しかし今回我々の研究グループでは、胎生中期と後期の神経幹細胞を同じ骨形成因子(BMP)で分化誘導刺激を行ったところ、発生時期に応じてニューロンとアストロサイトと異なる細胞種へと分化することを見出しました。そこでこの研究では、産生細胞種の異なる二つの発生時期の神経幹細胞において、BMPシグナルの下流の標的を全ゲノムレベルで解析することにより、神経幹細胞の運命転換が引き起こされる分子機構の解明を目指しました。
■内 容 マウス胎生11日(E11)と14日(E14)由来神経幹細胞をBMPで刺激した後、そのシグナル下流で働く転写因子Smadが結合する標的場所を、全ゲノムを対象に解析しました。その結果、E11とE14ではSmadの結合領域が大きく異なることが分かりました(図A)。一般的に、転写因子はクロマチンがオープンな領域に結合するため、E11およびE14由来神経幹細胞において、クロマチンのオープン度が高い領域を特定したところ、E11とE14で共通してSmadが結合した領域のクロマチンオープン度は発生時期によらず高いこと、一方、E11とE14で特異的なSmad結合領域はそのオープン度が異なり、オープン度がより高い時期に選択的にSmadが結合することが明らかとなりました(図B)。これらを遺伝子レベルで解析した結果、ニューロン分化促進的に働くプロニューラル遺伝子Neurog1近傍には、E11特異的にオープン度が高い領域が存在し、その領域にSmadがE11特異的に結合することが分かりました(図C)。一方、アストロサイト関連遺伝子であるGfap近傍にはE11と比べてE14でオープン度が高い領域があり、BMP刺激依存的にSmadがこの領域へと結合することも分かりました(図D)。
次に、クロマチンオープン度と相関するエピジェネティック修飾を調べたところ、遺伝子発現のOFFに関わる、DNAメチル化修飾やヒストンH3K27トリメチル化修飾とクロマチンオープン度が逆相関する事が分かりました。実際に、Gfap近傍のSmad結合領域には我々が以前に同定した発生時期依存的なDNA脱メチル化領域(R-DMR)がありますが(Sanosaka et.al., 2017)、DNAメチル化修飾の高いE11ではこの領域のクロマチンオープン度が低く、E14では高くなることが分かります(図D)。 さらに、Smadは単独でそれぞれの領域に結合するのではなく、発生時期に特徴的な発現パターンを示す、Sox遺伝子群の転写因子と相互作用することも明らかとなりました。すなわちSmadは、E11神経幹細胞では、その時期に発現が高く、ニューロン関連遺伝子の転写を誘導するSox11と会合する一方、E14神経幹細胞では、この時期の発現が高くアストロサイト関連遺伝子の転写を誘導するSox8と会合することにより、時期特異的にそれぞれニューロン及びアストロサイトへの分化を効率的に誘導することも分かりました。
以上のことより、神経幹細胞は発生時期に応じて、エピジェネティック修飾を変化させることでSmadがターゲットする領域のクロマチンオープン度を適切に制御しつつ、細胞種特異的な転写因子の発現基礎値を変えることで、Smadはこれらと相互作用し、より精確かつ厳密に産み出す細胞を制御していることが分かりました。
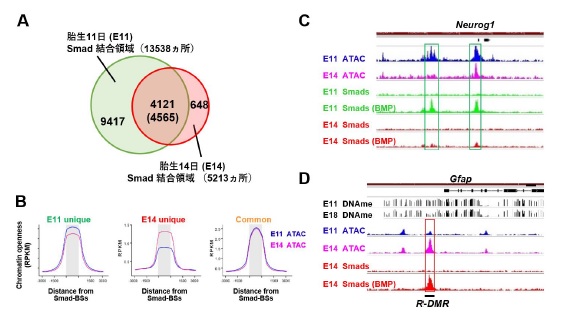
図A. 胎生11日、および14日由来神経幹細胞におけるSmad結合領域。B. 胎生11日と14日で共通してSmadが結合する領域のクロマチンオープン度は発生時期によらず高いが、胎生11日特異的Smad結合領域では胎生11日で、胎生14日特異的Smad結合領域では胎生14日でオープン度が高い。C, D. Neurog1, Gfap近傍におけるクロマチンのオープン領域(ATAC)とSmadの結合量および結合場所。
■効果・今後の展開
今回、神経幹細胞は、発生過程でエピゲノムを大幅に書き換えることにより、全く同じ細胞外因子に対しても時期特異的にその応答性を変化させ、異なる細胞を産み出していることが分かりました。しかし、このエピゲノムの書き換えが神経幹細胞でどのように生じているのかはまだ分かっていません。今後は、これらの課題に取り組みながら、このような精巧な神経幹細胞の分化制御機構が破綻した際に発症する発達障害や精神疾患などの病態理解にも、役立てていきたいと考えています。
【用語解説】
| (※1) | 神経幹細胞:増殖によって自分自身を複製する能力(自己複製能)と、脳を構成する主要な細胞種であるニューロン・アストロサイト・オリゴデンドロサイトへと分化する能力(多分化能)を併せもつ細胞。 |
| (※2) | エピゲノム:生物は全ての細胞(免疫系の一部の細胞を除く)で、共通の遺伝情報=ゲノムを有するが、個々の細胞では、遺伝子発現のON・OFFの目印として、化学修飾が施されている。これら化学修飾をエピジェネティック修飾、また化学修飾が施されたゲノムを、エピゲノムと呼ぶ。エピゲノムが発生過程に適切に変化するため、一つの受精卵から、我々の身体が形作られる。 |
| (※3) | 骨形成因子:もともと、筋肉内で骨の形成を誘導する生理活性物質として同定・命名されたが、現在では様々な組織・器官で細胞分化の誘導や制御を行い、また増殖や細胞死を調節するなど、発生過程で多彩な機能をもつことが知られている。細胞膜に発現する受容体に結合すると、細胞内でSmad1が活性化し、核内へと移行、Smad1が組織・細胞特異的な標的場所に結合することで、特定の遺伝子発現を誘導あるいは抑制する。 |
| (※4) | クロマチン構造:DNAは規則正しく結合したヒストンタンパク質に巻き付き、クロマチン構造をとることで核内に効率的に詰め込まれている。クロマチンが密に凝集している領域では、遺伝情報が読み取られない(OFF)が、オープンな領域にはさまざまなタンパク質が作用できるため、細胞外からのシグナルに応じて、遺伝子発現が誘導あるいは抑制される。 |
| (※5) | 転写因子:それぞれ特異的な配列を認識し結合、近傍遺伝子の発現をONもしくはOFFにする機能を有するタンパク質。近年、一つの転写因子は転写共役因子なども含めた複数の転写因子と相互作用することで、より特異的な場所に安定的に結合し、遺伝子発現の誘導もしくは抑制を効率よく行うことが分かってきている。 |
【論文情報】
| タイトル: | Neural stem/precursor cells dynamically change their epigenetic landscape to differentially respond to BMP signaling for fate switching during brain development. |
| 著者名: | *Sayako Katada, Jun Takouda, Takumi Nakagawa, Mizuki Honda, Katsuhide Igarashi, Takuya Imamura, Yasuyuki Ohkawa, Shoko Sato, Hitoshi Kurumizaka, and *Kinichi Nakashima |
| 掲載誌: | Genes & Development, 2021 |
【謝辞】
本研究は、日本学術振興会科研費(JP16H06527, JP16K21734, JP26710003, JP20K06875)、国立研究開発法人科学技術振興機構CREST(JPMJCR16G1)内藤記念科学研究助成金の支援を受けました。
【お問い合せ先】
本研究は、日本学術振興会科研費(JP16H06527, JP16K21734, JP26710003, JP20K06875)、国立研究開発法人科学技術振興機構CREST(JPMJCR16G1)内藤記念科学研究助成金の支援を受けました。
【お問い合せ先】
<研究に関するお問合せ先>
大学院 医学研究院 教授 中島欽一
Tel: 092-642-6195 Fax: 092-642-6561
Mail: nakashima.kinichi.718(a)m.kyushu-u.ac.jp
※(a)を@に置きかえてメールをご送信ください。

