2022.11.02
「アントラサイクリン系抗がん剤による心毒性の仕組みを解明・治療法を開発~心毒性の克服によりさらに最適ながん治療の実現と患者のQOL改善へ期待~」(寄附講座循環器病免疫制御学講座 [循環器内科学分野] 池田昌隆 助教、九州大学病院循環器内科 井手友美 診療准教授)
~心毒性の克服によりさらに最適ながん治療の実現と患者のQOL改善へ期待~
- ① 多くの癌種に対して標準治療薬として用いられるアントラサイクリン系抗がん剤(※1)は用量依存性(※2)に心臓機能障害(心毒性)を生じ、その予防法の開発は喫緊の課題です。
- ② アントラサイクリン系抗がん剤による心毒性の主な原因であるフェロトーシス(※3)が誘導される分子メカニズムの全容を解明し、5-アミノレブリン酸(※4)がアントラサイクリン系抗がん剤によるフェロトーシスを抑制することで心毒性を予防できることが分かりました。
- ③ 心毒性抑制薬としてのアミノレブリン酸の研究開発により、さらに最適ながん治療が実現できるとともに、心臓合併症の予防によりがん患者のQOLを改善することが期待されます。
アントラサイクリン系抗がん剤(代表薬剤:ドキソルビシン)は、乳がん・卵巣癌・血液腫瘍など多くの癌種に対する標準治療に用いられる抗がん剤です。しかしながら、用量(総投与量)依存性に心臓機能障害(心毒性)を引き起こします。心毒性により発症したアントラサイクリン心筋症は5年生存率が50%以下と極めて予後不良であり、重大な副作用です。このため、アントラサイクリン系抗がん剤の総投与量は厳密に制限されており、最適な抗がん剤治療の継続を困難にさせています。また、制限された投与量でも約10%程度に心毒性を生じ、がん患者のQOL低下の一因となっています。
本研究により、アントラサイクリン系抗がん剤の心毒性の主な原因であるフェロトーシスを誘導する分子メカニズムの全容を解明、病態基盤に基づき5-アミノレブリン酸による心毒性抑制法を開発しました。
九州大学大学院医学研究院の池田昌隆助教および九州大学病院循環器内科の井手友美診療准教授らの研究グループは、アントラサイクリン系抗がん剤による心毒性の主な原因である鉄依存性による細胞死・フェロトーシスが心筋細胞で誘導される分子メカニズムを解析しました。その結果、アントラサイクリンはミトコンドリアDNA(※5)に入り込むことで、ミトコンドリアに集積することが分かりました。一方、アントラサイクリンはヘム(※6)合成の律速酵素(※7)であるアミノレブリン酸合成酵素(ALAS1)の発現を著しく低下させ、ヘム合成を阻害していました。これにより、ヘム合成に利用されなくなった鉄がミトコンドリアに蓄積し、アントラサイクリンと複合体を形成、心筋細胞で過酸化脂質(※8, 脂質の“錆 [さび]”)を生じ、フェロトーシスを誘導することが分かりました。また、ALAS1が合成する5-アミノレブリン酸の投与により鉄の蓄積とフェロトーシスが抑制され、心筋症が予防できることが分かりました。
日本を含む全世界でがん罹患患者数は増加し続けており、それに伴いアントラサイクリン系抗がん剤の使用も過去10年で2倍に増え(世界市場ベース)、今後もさらに拡大することが見込まれています。そのため、心毒性の予防法の臨床開発は喫緊の課題です。本研究成果に基づく「アントラサイクリン系抗がん剤による心毒性抑制薬としてのアミノレブリン酸の研究開発」を進めることにより、最適ながん治療を実現できるとともに、心臓合併症を予防することによるがん患者のQOLの改善が期待されます。
本研究成果は米国の科学誌「Science Signaling」に2022年11月2日(水)午前4時(日本時間)に掲載されます。
アントラサイクリン系抗がん剤(代表薬剤:ドキソルビシン)は、乳がん・卵巣癌・血液腫瘍など多くの癌種に対する標準治療として用いられる抗がん剤です。しかしながら、用量(総投与量)依存性に心臓機能障害(心毒性)を引き起こすことから、その総投与量は厳密に制限されています。また、厳密な制限下での使用でも約10%程度に心毒性を生じ、心毒性により発症するアントラサイクリン心筋症の5年生存率は50%以下と予後不良です。
日本を含む全世界でがん罹患患者数は増加し続けており、アントラサイクリン系抗がん剤は過去10年間にその使用量は2倍に増え、今後もさらに増加することが見込まれる抗がん剤です。このため、アントラサイクリン系抗がん剤による心毒性の仕組みを解明し、予防法を開発することは、医学的のみならず社会的にも喫緊の課題です。さらに科学的見地からは、本来がん細胞の異常な増殖を標的とする抗がん剤が、ほぼ細胞増殖をしない心筋細胞に毒性を生じる仕組みは長らく不明でした。
池田、井手らの研究グループはこれまでにアントラサイクリンによりミトコンドリアに鉄が蓄積し、鉄依存性に生じる過酸化脂質(脂質の“錆 [さび]”)に基づく細胞死・フェロトーシスがアントラサイクリン心毒性の主な原因であることを明らかにしてきました(Tadokoro T, Ikeda M, Ide T et al., JCI Insight, 2020)。しかしながら、“なぜがん細胞や他の正常細胞よりも心筋細胞で毒性(フェロトーシス)を生じるのか”、“なぜミトコンドリアに鉄が蓄積するのか”は明らかになっていませんでした。
今回、本研究グループは心筋細胞にはミトコンドリアとミトコンドリアDNA(mtDNA)が豊富に存在することとアントラサイクリンがDNAに入り込む性質に着目し、mtDNAを人為的に増減することで、アントラサイクリンのミトコンドリアへの蓄積量を解析しました。これらの解析により、mtDNAの量に一致してアントラサイクリンがミトコンドリアに集積していることが分かりました。一方で、アントラサイクリン系抗がん剤は核DNAにも入り込み、細胞増殖を抑制することで抗がん作用を発揮しますが、心筋細胞ではアントラサイクリンにより核DNAにコードされるヘム(※6)合成の律速酵素であるアミノレブリン酸合成酵素(ALAS1)の発現が大きく低下することを発見しました。ヘム合成の最終段階はミトコンドリアにおいてプロトポルフィリンIX(※9)に鉄が組み込まれることで合成されますが、ヘムの合成障害により利用されなくなった鉄がミトコンドリアに蓄積していることが分かりました。これらの仕組みによりミトコンドリアに蓄積したアントラサイクリンと鉄は複合体を形成し、過剰な過酸化脂質が生成されることで、フェロトーシスを誘導していることを見出しました。
実際に、アントラサイクリン心筋症モデル動物にALAS1が合成するアミノレブリン酸を投与することで、鉄の蓄積とフェロトーシスを抑制し、心筋症の発症を予防することに成功しました。
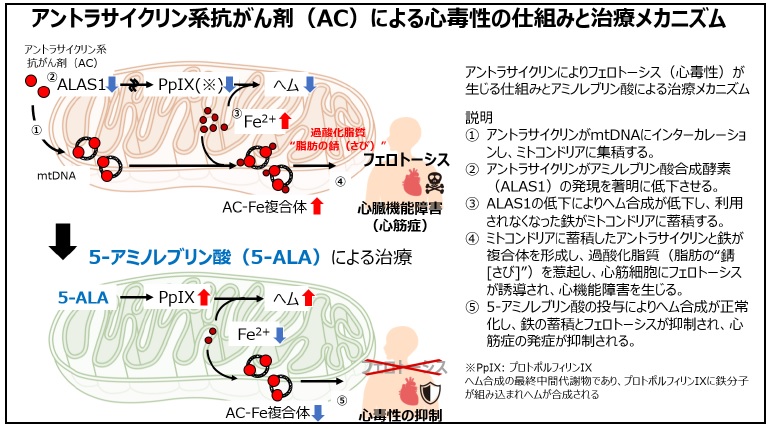
アミノレブリン酸は生体内で合成されるアミノ酸の1種です。既に診断薬(アラグリオⓇ)として医薬品の承認を受けており、ヒトでの安全性も確認されています。今後はアミノレブリン酸による心毒性の抑制薬としての開発を進めることで、さらに最適ながん治療を実現とするとともに、心臓合併症を予防することでがん患者のQOLを改善することが期待されます。
(※1) アントラサイクリン系抗がん剤:1967年にStreptomyces peucetiusから発見された抗腫瘍薬とその類似体の総称。天然に生成されているダウノルビシンの類似体として、ドキソルビシン、エピルビシン、イダルビシンなどが開発されている。現在でも多くの癌種に使用されるが、副作用として心毒性を生じることから、総投与量はドキソルビシン塩酸塩で500 mg/m2までに制限されている。
(※2) 用量依存性:薬などの量が増えれば増えるほど効果や障害などが起こる可能性が増すこと。
(※3) フェロトーシス:2012年に米国のDixonらにより提唱された鉄依存性に生じた過剰な過酸化脂質(脂質の“錆[さび]”)により生じる細胞死。
(※4) アミノレブリン酸:アミノレブリン酸合成酵素によってグリシンとスクシニルCoAから合成されるポルフィリン合成経路の最初の生成物であり、アミノ酸の1種。
(※5) ミトコンドリアDNA:細胞内小器官であるミトコンドリアが独自に有するDNA。ミトコンドリアDNAは約16kbpの環状2本鎖DNAであり、37の遺伝子をコードしている。ミトコンドリア1つあたりに複数のmtDNAを有し、核DNAでコードされる遺伝子とミトコンドリアDNAでコードされる遺伝子でミトコンドリアを形成する。心筋細胞では、細胞当たりのミトコンドリア数、またミトコンドリア当たりのmtDNAコピー数が特に多い。核DNAとは独立したmtDNAの存在は、ミトコンドリアが古くは外来由来のものであり、ミトコンドリアの細胞内共生説の根拠の一つとされる。
(※6) ヘム:活性中心に鉄分子を有する錯体。生体内で様々な蛋白に組み込まれ、重要な役割を担う。代表的な役割は、赤血球のヘモグロビンに組み込まれ、生体内での酸素運搬に重要な役割を果たす。
(※7) 律速酵素:一連の反応の中で、全体の反応速度を決定する酵素。
(※8) 過酸化脂質:酸化傷害を受けた脂質の総称。脂質の“錆(さび)”。
(※9) プロトポルフィリンIX(PpIX):ヘム合成経路の中間代謝物であり、ヘムの前駆体。
本研究はJSPS科研費 (JP16H07049, JP18K15892, JP21K16090, 17K09582, 20K08426)、上原記念生命科学財団、応用酵素協会(Vascular Biology Innovation)、公益財団法人MSD生命科学財団、Novartis Pharma Grants for Basic Research 2020、公益財団法人興和生命科学振興財団、九州大学病院AROシーズA、AMED (20ek0109339h0003)の助成を受けたものです。本研究は、九州大学大学院薬学研究院の山田健一教授、北里大学薬学部の今井浩孝教授らとともに行った共同研究です。
掲載誌:Science Signaling
タイトル:Doxorubicin causes ferroptosis and cardiotoxicity by intercalating into mitochondrial DNA and disrupting Alas1-dependent heme synthesis
著者名:Ko Abe, Masataka Ikeda, Tomomi Ide, Tomonori Tadokoro, Hiroko Deguchi Miyamoto, Shun Furusawa, Yoshitomo Tsutsui, Ryo Miyake, Kosei Ishimaru, Masatsugu Watanabe, Shouji Matsushima, Tomoko Koumura, Ken-ichi Yamada, Hirotaka Imai, Hiroyuki Tsutsui
DOI:10.1126/scisignal.abn8017
【お問い合わせ先】
九州大学大学院医学研究院 循環器病免疫制御学講座(循環器内科学分野)
助教 池田 昌隆(イケダ マサタカ)
TEL:092-642-5360 FAX:092-642-5374
Mail:ikeda-m★cardiol.med.kyushu-u.ac.jp
※★→@に置き換えてメールをご送信ください。

